薬機法の改正について(その4)
改正されました薬機法についてのコラム(その4)です。今回は、改正事項として「医療機器の特性に応じた承認制度の導入」について解説いたします。
1.改正事項の背景
医療機器とは、人や動物の疾病の診断、治療又は予防に使用され、身体の構造又は機能に影響を及ぼすことが目的とされている機械器具等で、政令で定めるものとされています。医療機器には、メス、手術用のハサミ、ピンセットからステント、ペースメーカー、MRI、手術用ロボットまで多種多様です。また、使用者の能力・技能により効果が影響されることなど、医薬品等とは異なる特性があります。そして、製品によっては改良・改善が行われ、特にプログラムを用いた医療機器では、市販後に顕著に変更が繰り返されています。更に、AI(人工知能)を活用した医療機器のように市販後に恒常的に性能等が変化する医療機器の開発や市販後に収集されるデータを利用した医療機器の改良なども進んできております。
従来、医療機器の継続的な改良については、その変更による製品への影響の度合いに応じ、臨床試験が必要な一部変更承認、非臨床試験で評価可能な一部変更承認及び軽微変更届という手続きが取られきました。しかし、継続的な改良の都度に手続きを繰り返すことは、手間と時間を要し、最新の医療機器への患者のアクセスが遅れるという問題があります。そのため、こうした医療機器への速やかな患者のアクセスの実現のため、医療機器の特性を踏まえた更なる規制が求められています。
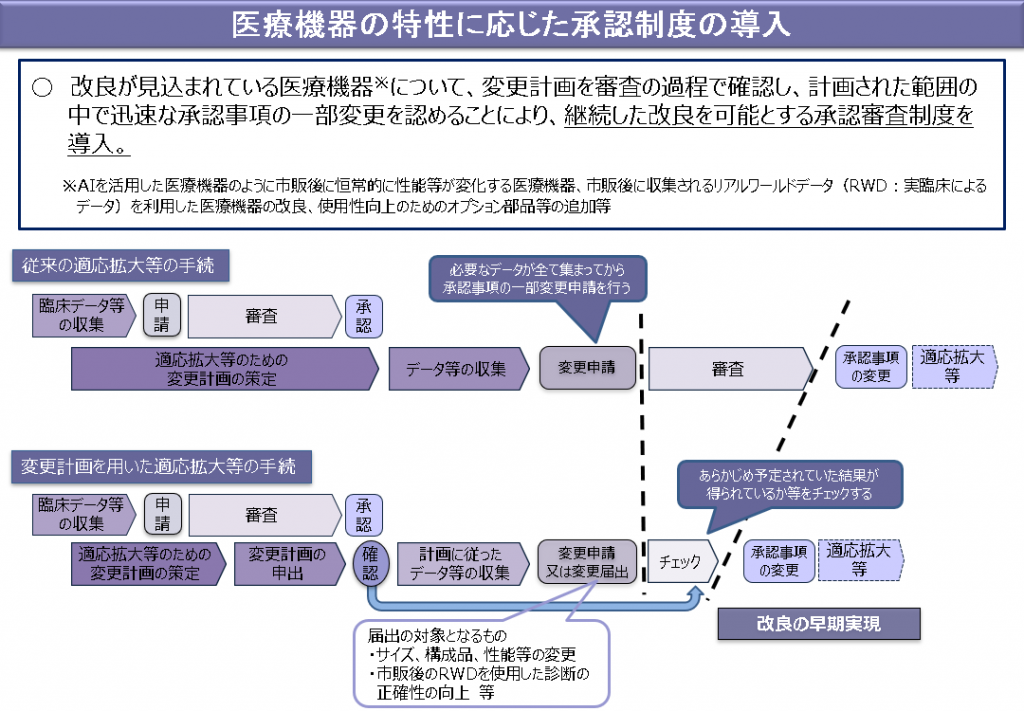
2.「医療機器の特性に応じた承認制度の導入」の内容(下図概要参照)
改良が見込まれている医療機器(体外診断用医薬品を含む)については、継続した改良を可能とする承認審査制度が導入されます。医療機器等の承認を受けた者は、承認事項のうち性能、製造方法等の変更に関する計画について厚生労働大臣の確認を受けることができます。また、確認を受けた者は、当該計画に従った変更(製造方法の変更その他の厚生労働省令で定める変更に限る。)を行う日の厚生労働大臣が定める日数前までに変更を行う旨を届け出たときは、変更に係る承認を受けることを要しないものとなります。
一方、厚生労働大臣は当該確認を受けた計画に従った変更(製造方法の変更その他の厚生労働省令で定める変更のみを行う場合を除く。)に係る承認申請の場合は、その審査において、品質、有効性又は安全性に関する調査に代えて、計画に従った変更であるかどうかの調査を行うことができるものとしています。
また、8月31日にこの新たな制度の詳細な手続きを示した厚生労働省令(「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律の施行に伴う関係省令の整備等に関する省令」(令和2年8月31日厚生労働省令第155号))が示されました。
この省令においては、「医療機器の特性に応じた承認制度の導入」について、主に以下の手続きが示されています。
(1)変更計画の確認の申請の区分
①医療機器(人工知能関連技術以外)
②医療機器(人工知能関連技術)
③体外診断用医薬品
(2)変更確認を受けることができる場合
①目的・効果
②形状・構造・原理
③原材料
④性能・安全規格
⑤使用方法
⑥管理方法
⑦有効期間
⑧製造方法
⑨製造所
(3)変更確認を受けることができない場合
①法で定められた基準に適合しない変更
②病原因子の不活性・除去方法に関する重要な変更
③品質・有効性・安全性に重大な影響を与えるおそれのある変更
(4)標準的事務処理期間 30日
医療機器の特性に応じた承認制度の導入の概要
「医薬品・医療機器等の品質・有効性及び安全性の確保等に関する法律等の一部を改正する法律案の概要」(厚生労働省説明資料より筆者改変)
以上、今回は「医療機器の特性に応じた承認制度の導入」について解説いたしました。この法改正による新たな制度の第一弾の施行が9月から開始されました。次回以降も、それぞれの改正事項について解説していきます。
文責:岡野内 徳弥
本コラムの無断転載を禁止いたします。

岡野内 徳弥(株式会社CDIメディカル 主査)
静岡県立大学大学院薬学研究科修了、マサチューセッツ大学ビジネススクール修了。
博士(薬学)、経営学修士。
厚生労働省、独立行政法人国立病院機構、独立行政法人医薬品医療機器総合機構、国立医薬品食品衛生研究所、環境省、法務省、神奈川県を経て、現在に至る。