薬機法の改正について(その5)
改正されました薬機法についてのコラム(その5)です。今回は、改正事項として「QMS(Quality Management System)適合性調査の見直し」について解説いたします。
1.改正事項の背景
医薬品、医療機器、体外診断用医薬品等は、国際的に流通するものであり、また各国において開発、製造競争が常になされています。そのため、これらの製品は国際的な整合性が強く求められ、合理的で企業の生産性向上に資する規制環境を整備することが必要です。
このような観点から、国際的な整合性のある品質管理手法の導入として、今回の法改正においては、「変更計画(PACMP)による承認事項の変更手続の見直し」、「GMP適合性調査等の見直し」及び「QMS適合性調査の見直し」という3つの制度の見直しが行われました。
ただし、「QMS適合性調査の見直し」は、この9月1日から施行されましたが、「変更計画(PACMP)による承認事項の変更手続の見直し」と「GMP適合性調査等の見直し」は、2021年8月1日の施行となっています。そのため、今回のコラムでは「QMS適合性調査の見直し」について解説いたします。
そもそもQMSとはQuality Management Systemの略ですが、薬機法においては「医療機器及び体外診断用医薬品の製造管理及び品質管理の基準(平成16年厚生労働省令第169号)」(以下、「QMS省令」)を示しています。これは、製造される医療機器及び体外診断用医薬品の品質確保ために必要とされる品質マネジメントシステムの基準です。QMS省令はISO13485に準拠しており、品質マネジメントシステムを構成する各サブシステム事項や運用方法に関する事項が定められています。以下が基準の主な内容です。
■品質管理監督システム(品質管理監督システムの一般要求事項、文書化に関する要求事項)
■管理監督者の責任(品質方針、計画、責任、権限及びコミュニケーション、マネジメントレビュー)
■資源の管理監督(資源の提供、人的資源、インフラストラクチャー、作業環境)
■製品実現(計画、プロセス、設計・開発、購買、製造・サービス提供、監視・測定機器の管理)
■測定、分析及び改善(測定・分析・改善の一般要求事項、監督、測定、不適合管理、データ分析、改善)
このように、医療機器及び体外診断用医薬品の製造販売業者には、製品の品質確保ためにQMS省令で示される基準への適合が定められています。
そして、QMS省令の基準への適合性については、都道府県、PMDA、登録認証機関(クラスⅡの認証基準がある製品のみ)により、承認等申請の際や定期的に調査が実施されます。この「QMS適合性調査」について、その一部が今回見直されました。
2.「QMS適合性調査の見直し」の内容
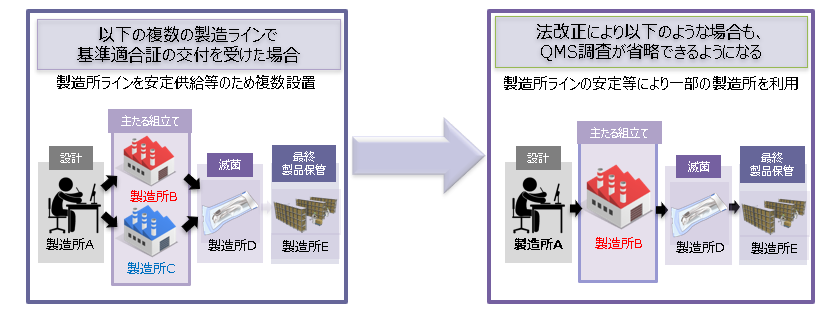
医療機器などを市場へ安定供給するためや製造販売業者が企業再編などにより、バックアップ等を目的として複数の製造ラインを持つことがあります。このような場合に、一定期間が経過後、メインの製造ラインで安定的に製造して、他の製造ラインの利用をしなくなるケースがあります。そのような場合でも、従来、QMS適合性調査を受けることが求められていました。しかし、このような状況に適切に対応するため、QMS適合性調査を受けた同一の製造工程を行う製造所である場合には、QMS適合性調査が不要となりました。(下図参照)
使用しない製造ラインでQMS適合性調査が不要(イメージ)
「医薬品・医療機器等の品質・有効性及び安全性の確保等に関する法律等の一部を改正する法律案の概要」(厚生労働省説明資料より筆者改変)
具体的には、QMS適合性調査の申請を要しないために以下の要件が示されています*。
医療機器及び体外診断用医薬品の承認等前適合性調査(法第23条の2の5第8項等)において、既に交付を受けてる基準適合証が(1)から(4)までの全てを満たす場合、申請を行うことを要しないものであること。
(1)基準適合証に記載された製品群区分が、調査申請品目の一般的名称及び品質特性に照らし、妥当であること。
(2)承認書等に記載された全ての登録製造所 (滅菌又は最終製品の保管のみを行うものを除く。以下「関係登録製造所」という。)が 基準適合証に記載された登録製造所であり、かつ、関係登録製造所における製造工程と基準適合証に記載された登録製造所における製造工程が同一であること。
(3)適合性調査を受けるべき期日において、有効な基準適合証を有していること。
(4)適合性調査の申請者が、基準適合証の申請者欄に記載されていること。*:「基準適合証及びQMS適合性調査申請等の取扱いについて」(薬生監麻発0831第1号、薬生機審発0831第16号、令和2年8月31日)から、筆者抽出・改変、下線部が見直しに該当
以上、今回は「QMS適合性調査の見直し」について解説いたしました。次回以降も、それぞれの改正事項について解説していきます。
文責:岡野内 徳弥
本コラムの無断転載を禁止いたします。

岡野内 徳弥(株式会社CDIメディカル 主査)
静岡県立大学大学院薬学研究科修了、マサチューセッツ大学ビジネススクール修了。
博士(薬学)、経営学修士。
厚生労働省、独立行政法人国立病院機構、独立行政法人医薬品医療機器総合機構、国立医薬品食品衛生研究所、環境省、法務省、神奈川県を経て、現在に至る。